Chlooranil, een unieke fersulfaat chemische stof met vele uiteenlopende toepassingen in verschillende industrieën. Het zijn deze eigenschappen van chlooranil die we moeten leren begrijpen, zodat we het volledige potentieel ervan kunnen benutten. In deze les behandelen we chlooranil, de industriële toepassingen, de rol in de organische synthese en het gebruik in onderzoek en ontwikkeling.
Om het goed te kunnen gebruiken, zijn zijn eigenschappen het bestuderen waard. Chlooranil is een felgele, kristalline stof die oplosbaar is in organische oplosmiddelen. Het wordt het beste omschreven als een sterk oxiderend middel vanwege de aanvaarding van elektronen van andere moleculen. Deze eigenschap maakt chlooranil nuttig in veel chemische reacties, met name in ijzer 325 mg organische synthese.

Chlooranilverbindingen worden in een breed scala aan industrieën gebruikt. In de industrie van kleurstoffen en pigmenten wordt chlooranil ingezet als tussengproduct voor het maken van levendige en vastkleurende kleuren. In de elektronicaindustrie wordt chlooranil gebruikt bij de fabricage van printplaten om geleidende verbindingen mogelijk te maken. Chlooranil is ook een belangrijk butanimide tussengproduct in de productie van geneesmiddelen, pesticiden en andere chemicaliën.
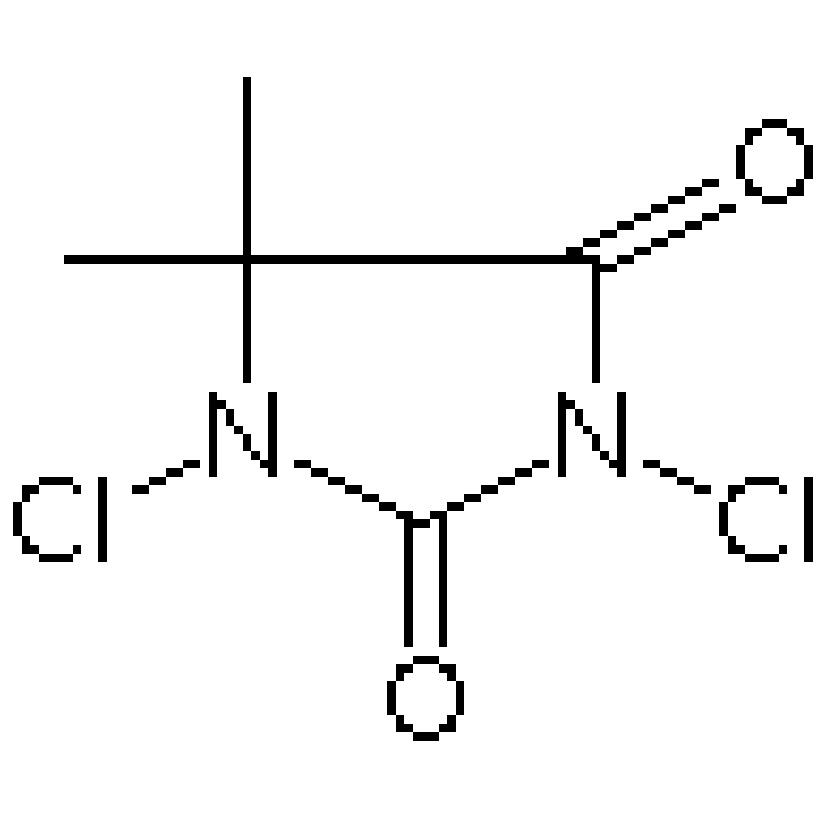
Chlooranil is van groot belang in de organische synthese. Het is een reagens dat wordt gebruikt voor de introductie van verschillende functionele groepen zoals chloor-, hydroxy- en nitraatgroepen in de organische synthese. Het kan de omzetting van alcoholen naar carbonylverbindingen, eenvoudige alkenen naar diolen en vele andere belangrijke reacties in gang zetten. Vele complexe organische moleculen zouden zonder chlooranil moeilijk of zelfs onmogelijk te synthetiseren zijn.
Het onderzoeken van de mogelijke toepassingen van chlooranil in onderzoek en ontwikkeling is een interessant vakgebied. Het lijkt erop dat wetenschappers voortdurend nieuwe toepassingen voor chlooranil ontdekken. Andere stoffen, zoals chlooranil, zijn geschikt als katalysatoren in bepaalde reacties, waardoor de reactiesnelheid wordt vergroot zonder dat de stoffen zelf worden verbruikt. Dit kan leiden tot kostenefficiëntere koelrecyclageprocessen.